我們常遇到的問題是:都已經加了漂白水(次氯酸鈉溶液)殺菌了,為何測得的總生菌數還是高呢?
一、首先要了解的是餘氯的化學特性與水中酸鹼值 pH 的關係至關重要,從次氯 酸鈉水解方程式到餘氯的解離可逆方程式,可以回答為何次氯酸鈉殺菌無效的問題。
(1)次氯酸鈉的水解方程式:
液氯(學名:次氯酸鈉,俗名:漂白水,化學式: NaOCl)一般係以 10~12% 溶液的 型態為商用運送規格。當漂白水(次氯酸鈉 NaOCl)溶於水時,它會水解成為液鹼
(氫氧化鈉 NaOH)與次氯酸(HOCl),如反應式(1)所示: NaOCl + H2O → NaOH + HOCl (1)
因為上式(1)的右邊產出物:液鹼(NaOH)扮演了關鍵的角色,那就是加入漂白水後, 水中的 pH 值會因為液鹼的產生而將原水的 pH 值迅速拉升到 pH>10 左右。 次氯酸(HOCl)---氯在水中最重要的存在型態----亦稱為〝游離氯〞或〝餘氯〞
(free available chlorine),它係為負責殺死微生物之主要藥劑。然而次氯酸
(HOCl)在水中係為弱酸,亦即它會部份解離成次氯酸根離子(OCl-),如反應式(2)所示。與次氯酸(HOCl)不同的是,次氯酸根離子(OCl-)係為殺菌力非常弱的殺菌劑。
(2) 餘氯的解離可逆方程式: 從(1)式中得知,加到水中的次氯酸鈉溶液的產出反應物為液鹼(NaOH)與餘氯 (HOCl)。而餘氯(HOCl)卻受限於 pH 的相依而產生了分子態餘氯(HOCl)與離子 態的 OCl-並存。
HOCl ↹ H+ +OCl-
(2) 特別註明上列反應式(2)是可逆反應式,即左右兩邊的反應→與←是隨著 pH
的變化而互為因果,次氯酸(HOCl)係為強氧化劑(氧化電位 ORP:1,490 mV)
與有效的殺菌劑;而次氯酸根離子(OCl-)則為較弱的氧化劑(氧化電位 ORP: 940 mV)與非常弱的殺菌劑。在水中通常會達到活躍的平衡,氯會在分子態的 次氯酸(HOCl)與離子態的次氯酸根離子(OCl-)之間前後移動。
二、餘氯(HOCl)與酸鹼值 pH 的關係:
下圖 1.為餘氯(HOCl)與 pH 相依的解離曲線的解離曲線,次氯酸(HOCl)的 pH 解離曲線而橫座標為 pH 值 2 條各為在溫度 00C 與 200C 的曲線,縱座標的左方:
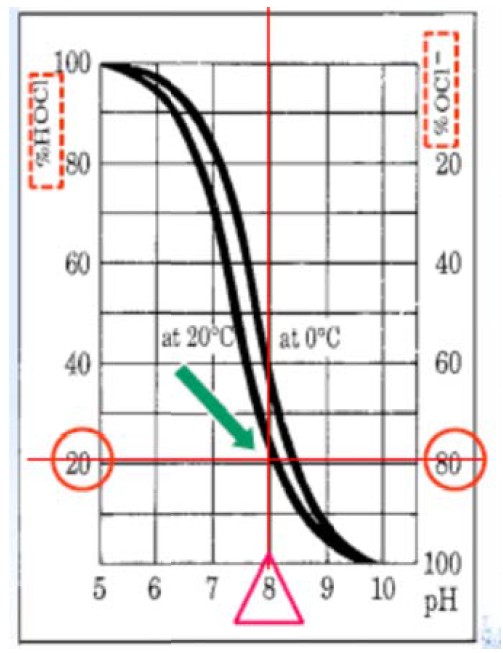
圖 1. 餘氯(HOCl)與 pH 相依的解離曲線
(1)酸性: 若水的 pH 值為酸性: 在反應式(2)中,代表酸的氫離子(H+)決定氯在 水中的性質方面扮演重要的角色,氫離子(H+)濃度高,就會驅動反應式(2)往 左←移動,會使氫離子(H+)與次氯酸根離子(OCl-)結合形成更多的次氯酸
(HOCl),即氯的殺菌劑型態,其殺菌效能極高。
(2)中性(pH=7): 若水的 pH 值為中性時,水
80%的氯會呈次氯酸分子態
(HOCl),而另外的 20%則呈次氯酸根離子態(OCl-)。在中性水環中,其殺菌 效能亦是極高。
(3)鹼性(pH>7): 若水的 pH 值為鹼性時,氫離子(H+)濃度就低。這將改變反應式
(2)的平衡向右→移動,導致水中的次氯酸(HOCl)產生解離,生生成氫離子(H+) 與次氯酸根離子(OCl-),即氯的非殺菌劑型態,其殺菌效能極低。
所以若在供水的水槽內加入 10 ppm 的次氯酸鈉溶液(就是漂白水:NaOCl)時,它 會發生什麼狀況?當依據反應式(1)中所產生的液鹼(NaOH)會立刻使 pH 會上 升,而因為 pH 的增加導致了 HOCl/OCl-平衡朝著 OCl-端移動。倘若在漂白水加 入之前,水的 pH 為 7.5,添加之後會立即升高到 pH 9~10,則氯的 10 ppm 總 劑量之中,實際上僅僅約 2 ppm 提供任何的殺菌作用。在此情況下,加入的 8 ppm 次氯酸鈉溶液(就是漂白水:NaOCl)就等同浪費。